今天我们讲一个化合物逆袭的故事。
1881年,一个不太有名的化学家Grodzki在柏林研究硫脲化合物。他做了一个实验,得到了一种味道有点像大蒜的化合物——双硫仑。由于含有硫元素的有机化合物大多不太好闻,Grodzki也没有发现双硫仑有什么其他特殊的性质,于是就写了一篇小文章,在德国化学家学会期刊上发表了自己的新发现[1]。当时的德国,有机化学领域群星灿烂,各种新奇化合物层出不穷,也就没有人去多关注这样一个看似平淡无奇的化合物。
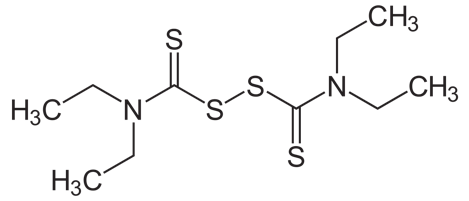 双硫仑化学式。图片来源:Wikipedia
双硫仑化学式。图片来源:Wikipedia
但是双硫仑可以有效地加快橡胶的硫化过程,于是,让Grodzki没想到的是,二十几年后,随着橡胶工业飞速发展,双硫仑得到了广泛的应用。而橡胶工业从此也有了一个谜一样的巧合——橡胶工业的工人都不能沾酒,稍一接触酒精就会满面通红,心跳加速,甚至会神志模糊。
1937年,一个名叫E. E. Williams的驻厂医生指出,可能就是橡胶厂里大量使用的双硫仑引起了这些症状。Williams医生认为,双硫仑或许可以用来帮人戒酒 [2]。然而很遗憾的是,Williams医生也没有太大名气,他的文章也没有引起太多关注。
但这都没有阻止双硫仑的逆袭。在Williams医生的研究之后几年,哥本哈根大学的Erik Jacobsen在研究双硫仑时,再一次发现了双硫仑与酒精对人体的影响。他发现,双硫仑抑制了在酒精代谢过程中极为重要的乙醛脱氢酶,导致酒精代谢产生的乙醛在人体内大量积累,于是出现类似酒精中毒的反应。在Jacobsen的努力下,双硫仑被开发成了一款戒酒药物,取名“安塔布司”,取“戒除滥用(酒精)”之意。
 1950年代时的Erik Jacobsen(右)与他当时的合作者Hald(左)。图片来源: quitalcohol.com
1950年代时的Erik Jacobsen(右)与他当时的合作者Hald(左)。图片来源: quitalcohol.com
六十多年后,戒酒药双硫仑再一次逆袭——多个研究发现,双硫仑竟然有抗癌作用!可以杀灭乳腺癌、前列腺癌等多种肿瘤细胞[4-6]。而长达60多年的“戒酒药历史”,证明双硫仑十分安全,它的副作用相比大多数肿瘤的化疗药物来说小得多了。
但是,双硫仑为什么能够抗癌呢?
最早的一些文献认为,可能由于双硫仑抑制了细胞里的“垃圾回收站”——“蛋白酶体”[7]。当细胞需要清理掉某些蛋白质时,会用一种称为泛素的分子给这些废弃的蛋白质先做个标记,然后,蛋白酶体会接收这些有泛素标记的蛋白质,把它们分解成为小片段回收利用。蛋白酶体对于肿瘤细胞至关重要,它一方面可以降解细胞合成的蛋白质“残次品”,另一方面也会降解一系列被称为“抑癌基因”的蛋白产物(例如如p53,Rb等等),从而促进癌细胞的无限增殖。正因为此,蛋白酶体抑制剂,比如硼替佐米,已经被开发为化疗药物。
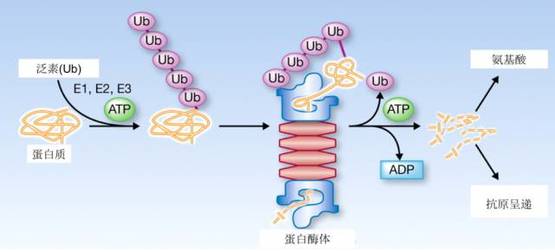 蛋白酶体会接收被“泛素”标记的蛋白质,并把它们降解。如果抑制蛋白酶体的活性,那么肿瘤细胞就会难以生存。图片来源:参考文献[3] | 翻译:云销雨霁
蛋白酶体会接收被“泛素”标记的蛋白质,并把它们降解。如果抑制蛋白酶体的活性,那么肿瘤细胞就会难以生存。图片来源:参考文献[3] | 翻译:云销雨霁
然而最新的研究发现,双硫仑还有更多惊喜。最近,来自捷克的Zdenek Skrott等人在《自然》(Nature)杂志上发表了他们新的发现——双硫仑并没有直接抑制蛋白酶体,而是使用了一种全新的抗癌机制[8]。
研究人员首先分析了双硫仑在体内抗癌的有效成分。很多药物在体内都会经过代谢,转化为一系列代谢产物,因此真正有活性的抗癌成分,不一定是药物本身。双硫仑在体内会被分解成为一种名叫DTC的化合物,而DTC可以牢牢地结合铜离子,形成一个络合物。研究人员发现,在小鼠的肿瘤内部,DTC-铜络合物(CuET)的含量显著高于其他正常组织,所以他们推测,CuET很可能与抗癌相关。进一步的实验发现,给小白鼠直接服用CuET就可以起到治疗癌症的作用,说明CuET应该就是双硫仑在体内代谢后,能够有效抗癌的活性产物。
 双硫仑的代谢产物。左边分别是DTC,双硫仑(DSF)和铜络合物(CuET)的化学分子式。右图展示的是,在给小鼠服用双硫仑(黑色点),或者双硫仑+葡萄糖酸铜时(红色点),肿瘤组织里CuET含量显著高于肝脏、脑和血清。图片来源:参考文献[8]
双硫仑的代谢产物。左边分别是DTC,双硫仑(DSF)和铜络合物(CuET)的化学分子式。右图展示的是,在给小鼠服用双硫仑(黑色点),或者双硫仑+葡萄糖酸铜时(红色点),肿瘤组织里CuET含量显著高于肝脏、脑和血清。图片来源:参考文献[8]
然而继续深入的实验又发现,在肿瘤细胞中,双硫仑的代谢产物CuET并没有影响蛋白酶体的活性,但是被泛素标记的蛋白却出现了异常积累。研究人员决定跟踪这些被泛素标记了的蛋白的动向。在细胞生物学中,常用一种被称为“荧光漂白后恢复”(FRAP)的方法来跟踪荧光分子的运动。在这个方法中,首先用一束强激光照射细胞的一个小区域,“漂白”这个区域中的荧光蛋白,让这些蛋白不再有荧光。“漂白”之后,当细胞中其他区域的荧光蛋白再次扩散进入被漂白的区域时,被漂白区域的荧光就会逐渐恢复。荧光恢复所需的时间,就反映了荧光分子的扩散速率——恢复越快,扩散运动越快。蛋白的扩散运动,会受到与它结合的组分的影响,当扩散速率出现异常时,往往说明蛋白之间的相互作用受到了影响。
实验人员使用绿色荧光蛋白标记了泛素,这样所有被泛素标记的蛋白都会有绿色荧光。在随后的荧光漂白与恢复中,用CuET处理过的细胞,荧光恢复需要格外长的时间,说明CuET抑制了泛素标记的蛋白运动。一个蛋白被泛素标记后,只是相当于是被打上了“报废处理”的标签,如果说蛋白酶体是细胞的“垃圾回收站”,那么还需要有一系列“蛋白垃圾收集车”把这些需要处理的蛋白送进蛋白酶体,然后才能开始降解回收的工作。
细胞里面的“垃圾收集车”有很多种,p97复合体(p97-NPL4-UFD1)就是十分重要的一种 。研究人员使用这个复合体的抑制剂NMS873处理细胞,发现了与用CuET处理细胞时相似的现象——荧光恢复也变慢了。所以推测,CuET就是影响了这些“垃圾收集车”的工作,导致那些被泛素标记出的蛋白只能原地等候,于是扩散运动减缓了,漂白后的荧光恢复也就需要更长的时间了。
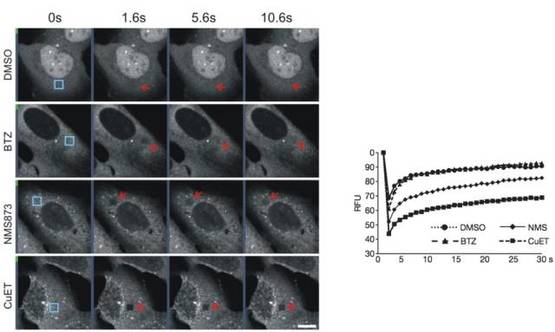 荧光漂白与恢复实验。细胞内泛素化蛋白都有荧光标记。当图中蓝色小方框内的荧光被漂白后,对照组(DMSO)或者用蛋白酶体抑制剂(BTZ)处理的细胞,方框内的荧光会快速恢复,但是用 CuET或是p97 复合体抑制剂(NMS873)处理过的细胞,荧光需要很久才能恢复,细胞上一直有一个黑色的方框。右侧的图显示是方框内荧光强度随时间的变化。图片来源:参考文献[8]
荧光漂白与恢复实验。细胞内泛素化蛋白都有荧光标记。当图中蓝色小方框内的荧光被漂白后,对照组(DMSO)或者用蛋白酶体抑制剂(BTZ)处理的细胞,方框内的荧光会快速恢复,但是用 CuET或是p97 复合体抑制剂(NMS873)处理过的细胞,荧光需要很久才能恢复,细胞上一直有一个黑色的方框。右侧的图显示是方框内荧光强度随时间的变化。图片来源:参考文献[8]
无论是抑制蛋白酶体这个“蛋白垃圾回收站”的工作,还是抑制p97复合体这个“垃圾收集车”,最终都会影响泛素标记蛋白的降解。这些被标记的蛋白中,很大一部分是细胞生产的蛋白质“残次品”,如果这些“残次品”积累起来,会严重影响细胞的生理活动,激发细胞的“应激反应”(stress response),最终影响细胞的生存。对于肿瘤细胞来说,因为细胞代谢格外旺盛,所以也会产生比普通细胞更多的蛋白质“残次品”,CuET抑制了这些蛋白质“废弃物”的处理,导致大量“垃圾”堆积在肿瘤组织内,影响肿瘤细胞的正常生理活动,最终“活活被垃圾憋死”。而CuET在肿瘤组织内富集的特点,又使得肿瘤细胞受到了额外伤害。这就是戒酒药双硫仑能够比较有选择性地杀灭肿瘤细胞的原因。
就这样,在这一百多年的时间里,双硫仑从一个默默无闻的化合物,到称霸橡胶行业的橡胶处理剂,再到戒酒药,最后成为抗癌新星,强势逆袭。谁能想到,最开始它可能只是一个小实验室的“灌水之作”呢?(编辑:明天)
特别提醒
双硫仑的抗癌作用还处于试验阶段,想真正用于癌症治疗,还需要大量的临床试验和评估。而且双硫仑属于处方药,服用需遵医嘱,也可能出现严重的副作用。所以,尽管研究成果喜人,请不要盲目尝试。
参考文献:
- Grodzki, M. Ueber äthylirte Sulfoharnstoffe. Ber. Dtsch. Chem. Ges., (1881),14: 2754–2758.
- E. E. Williams, “Effects of Alcohol on Workers with Carbon Disulfide,” J. Am. Med. Assoc., (1937), 109, 1472-1473.
- Molineaux, Susan M. "Molecular pathways: targeting proteasomal protein degradation in cancer." Clinical Cancer Research 18.1 (2012): 15-20.
- Pantziarka, P. et al. The repurposing drugs in oncology (ReDO) project. E cancer medical science 8, 442 (2014).
- Iljin, K. et al. High-throughput cell-based screening of 4910 known drugs and drug-like small molecules identifies disulfiram as an inhibitor of prostate cancer cell growth. Clin. Cancer Res. 15, 6070–6078 (2009).
- Cvek, B. Nonprofit drugs as the salvation of the world’s healthcare systems: the case of Antabuse (disulfiram). Drug Discov. Today 17, 409–412 (2012).
- Chen, D., et al. Disulfiram, a clinically used anti-alcoholism drug and copper-binding agent, induces apoptotic cell death in breast cancer cultures and xenografts via inhibition of the proteasome activity. Cancer Res. 66, 10425–10433 (2006).
- Skrott, Z., et al. Alcohol-abuse drug disulfiram targets cancer via p97 segregase adaptor NPL4. Nature. (2017).
