在外国“翻车”的疫苗,国内还有戏吗?
5月将近,全球新冠疫苗接种工作仍在争分夺秒地推进,见诸媒体的副反应案例亦日渐增多。值得注意的是,这些副反应,多数源于腺病毒疫苗。
陈颖 | 作者
李拓丨编辑
放大灯团队 | 策划
世卫组织信息显示,到4月中旬,各国已经批准的疫苗中,基于腺病毒载体的新冠疫苗获批最多(达到4款),超过其它类型的疫苗[1]。它们的研发者分别是英国牛津-阿斯利康(含印度血清研究所)、强生、俄罗斯加马列亚国家研究中心+俄罗斯直接投资基金(RDIF)、中国军科院+康希诺生物股份公司(以下简称康希诺)。
由于副反应案例较多,阿斯利康疫苗曾在今年3月一度被挪威、冰岛、奥地利、丹麦等十国暂停使用。4月14日,丹麦国家卫生局与药品管理局干脆宣布,不再为国民接种牛津-阿斯利康疫苗,成为全球首个停用阿斯利康疫苗的国家[2]。
在美国,6名女性因接种强生(Johnson & Johnson)新冠疫苗出现罕见严重血栓病例(年龄分布为18岁至48岁)。当地时间4月13日,美国FDA、CDC共同宣布,建议暂停接种强生腺病毒载体新冠疫苗[3]。
虽然现在并不能断定腺病毒新冠疫苗彻底“翻车”,但中国的腺病毒新冠疫苗公司,将面临两个大问题。

安全问题:百万分之一的血栓概率
1953 年,科研人员从从腺样组织分离出来“人腺病毒”(human adenovirus,HAdV)。目前,该病毒已经发现共 7 种(A ~ G)、60 多个血清型。全球范围内仅美国对 HAdV 疫苗进行过系统性的研究[4]。
腺病毒可以作为载体,进行各种疫苗的研发。新冠疫苗只是其中一种。
在新冠疫苗之前,被批准面向大众使用的腺病毒载体疫苗,只有两款埃博拉疫苗。(可移步至《腺病毒载体安全吗?| 117三人行》,了解腺病毒疫苗的历史)
2017年10月,中国的腺病毒埃博拉疫苗(Ad5-EBOV)获批。这款疫苗由中国军科院与康希诺联合研发。但它仅用于应急使用及国家储备[5],后续未大规模量产[6]。
2020年7月,强生的腺病毒埃博拉疫苗Zabdeno获得欧盟委员会(EC)批准。这款疫苗以人26型腺病毒(Ad26)为载体,与另一只疫苗Mvabea组成了一套双剂接种方案。到2020年3月,Zabdeno在全球的接种量才刚刚超过21.5万剂[7]。
使用腺病毒进行疫苗研究开发的,还有结核病疫苗等。以结核病疫苗为例,各家都还在临床试验阶段,当前均未获批和量产。
Clinicaltrials.gov的最新数据显示,牛津大学正在招募Ⅱ期临床试验志愿者;俄罗斯生物生物安全问题研究所已完成Ⅰ期临床试验;麦克马斯特大学则有两项临床,一项在招募Ⅰ期入组志愿者,另一项Ⅰ期已结束。
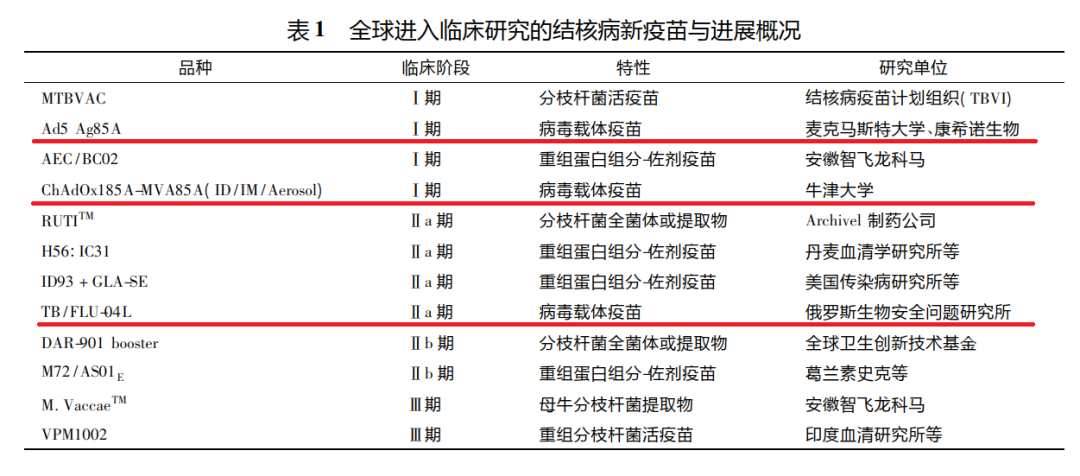
全球新型结核病疫苗进展:使用腺病毒载体的有麦克马斯特+康希诺、俄罗斯生物安全问题研究所和牛津大学[8]。
也就是说,在新冠疫情之前,全球从未有接种百万、千万级别规模腺病毒疫苗的先例。
一位疫苗专家在接受《第一财经》采访时表示,腺病毒疫苗导致血栓非常罕见。只有在阿斯利康或者强生这样大规模的接种中,才会发生[9]。
阿斯利康和强生新冠疫苗的接种规模有多大?
数据显示,发现6名血栓病例时,强生疫苗在美国共接种约680万剂[3]。4月16日,全球疫苗安全咨询委员会称,英国国民接种阿斯利康疫苗后,出现血栓的概率约每100万成年人中有4例(疫苗在英国已接种超2000万剂)。而在欧盟,这一风险约为每10万例中有1例[10]。
综合来看,腺病毒疫苗导致血栓的概率在十万分之一到二十五万分之一。
全球共有4款腺病毒疫苗获批上市。中国民众能打上的,其实只有天津康希诺生物的重组腺病毒疫苗Ad5-nCov(商品名“克威莎”)。这款疫苗于2021年2月25日获NMPA附条件批准上市。
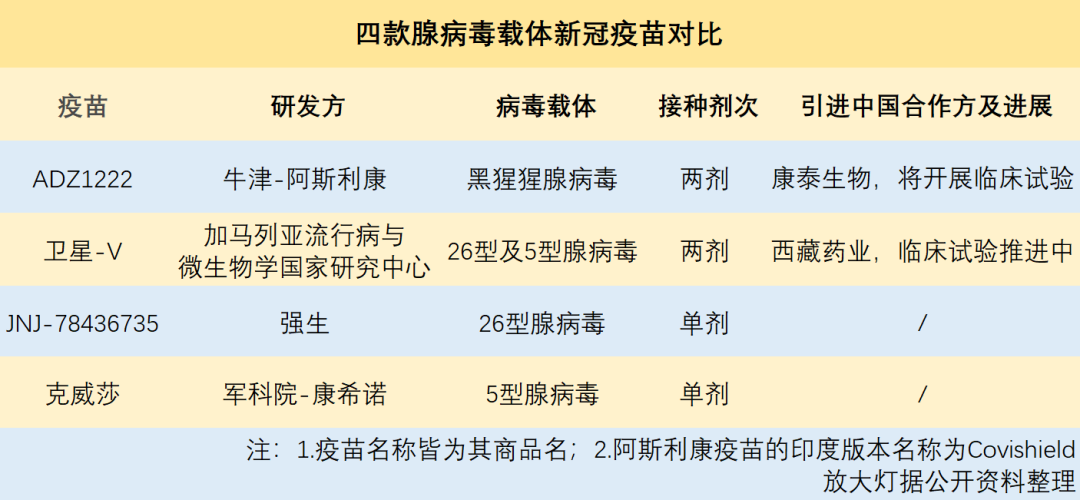
由于同为腺病毒技术路线,在美国监管方建议强生疫苗暂停接种的消息传出后,波动立刻传导了过来——4月14日,康希诺A、H股股价双双大跌。
康希诺急忙救场,它在当天盘中发布公告称,其重组新冠病毒疫苗使用的载体是5型腺病毒,与强生、阿斯利康的病毒载体均有所不同——阿斯利康使用的是黑猩猩腺病毒载体,强生使用的是人26型腺病毒载体(Ad26)。
且截至公告日,接种其疫苗约百万人中未收到与血栓相关的严重不良事件的报告[11]。截至收盘,康希诺A股股价跌6.29%,H股股价跌7.54%。
强生、阿斯利康的疫苗是在接种数百万乃至上千万剂后,才出现了血栓个例。康希诺的疫苗是否会导致血栓,或许要等待更大规模的数据。
4月21日,联防联控机制科研攻关组疫苗研发专班专家组成员邵一鸣表示,目前还没有观察到康希诺腺病毒载体新冠疫苗导致血栓的报告。但是药监部门要求,在监控当中特别关注使用腺病毒载体疫苗的血栓问题。“我们国家有非常健全的不良反应监测系统,这个可以让百姓放心,一旦发现任何问题,我们会采取措施。”[12]
一位腺病毒疫苗行业人士对放大灯团队(ID:guokr233)表示,尽管强生与阿斯利康出现了血栓问题,但接种腺病毒疫苗利大于弊,算是目前的行业共识。
对国内腺病毒新冠疫苗公司来说,除了悬而未决的安全争议,产能问题可能更棘手。

腺病毒疫苗,不是想造就能造
事实上,国内生产重组腺病毒疫苗的厂商,不只康希诺一家。
公开资料显示,目前,我国从事腺病毒新冠疫苗生产的企业,至少有6家。其中,康希诺是自主研发和生产,并已接种了约100万剂。其余几家则是引进外企疫苗或代工,且都还未启动疫苗生产。
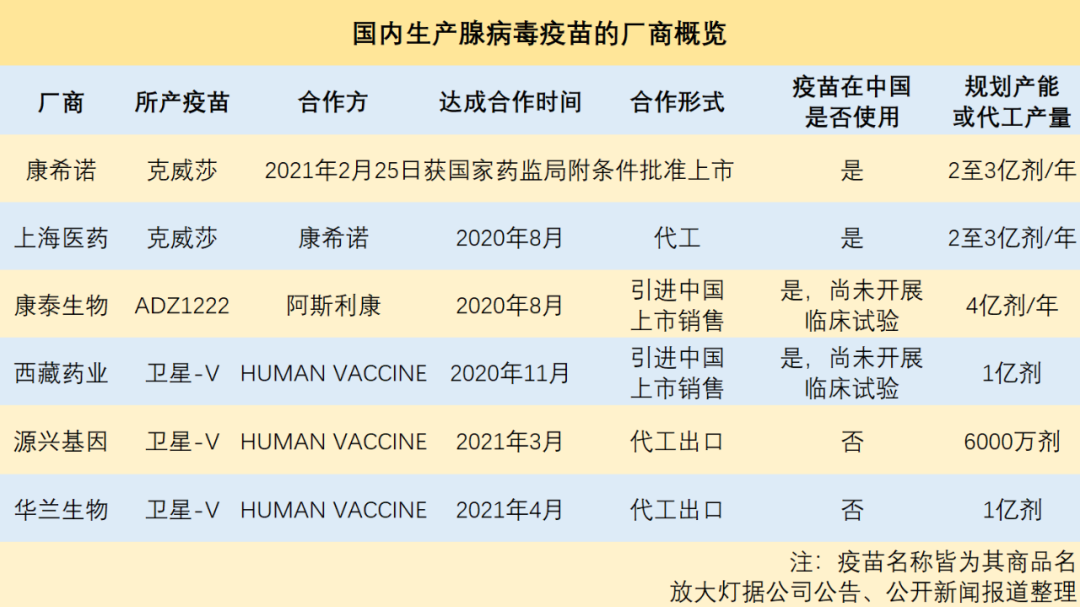
国内某腺病毒疫苗生产厂商的高层向放大灯团队介绍,在我国生物制药行业,腺病毒疫苗对生产工艺的要求比较高,算是一个新领域。此前能量产腺病毒疫苗的厂商,国内目前几乎没有。目前说是要进行腺病毒疫苗生产的企业们,其实也都还在建设产能。
这位业内人士还补充到,虽然康希诺的腺病毒疫苗已获批准,但施打的人却很少,就是在产能上遇到了问题。
但康希诺管理层对产能的预计却十分乐观。在2020年业绩交流会上,康希诺管理层表示,目前公司有3个新冠疫苗生产基地——已投产的天津工厂,7月份投产的上海工厂,两地工厂分别有2亿~3亿剂年产能。此外,外部委托生产的产能约有1亿剂[13]。
以此计算,今年康希诺的产能可达到5亿至7亿剂。
克威莎的上市,让连年亏损的康希诺有了第一款上市产品。财报显示,公司2020年营收为2489.04万,较上年增长2260多万。归母净利则亏损3.97亿,较上一年扩大2.40亿[14]。
毫无疑问,克威莎的市场表现,将直接影响康希诺在商业化元年的表现。
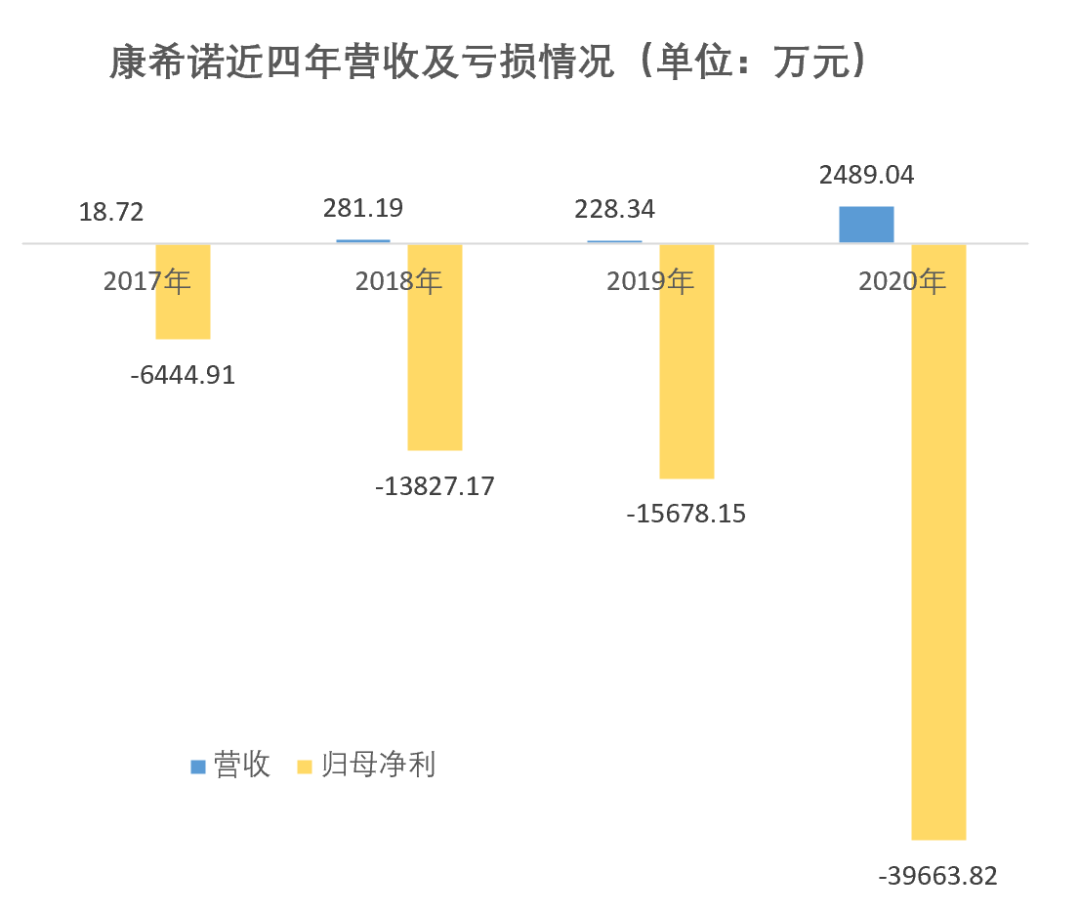
数据来源 | 康希诺科创板招股书、科创板2020年财报
目前,国内每天可接种超350万余剂疫苗(至4月22日七日平均)[15]。中国生物和科兴的疫苗是其中的主力。
全国新冠疫苗已累计接种超2.0亿剂次[12]。若按康希诺100万剂的接种量,仅占总接种量的约1/200。对于康希诺来说,目前最紧要的事情就是提升产能。否则,面对疫苗大户中国生物和科兴,康希诺在国内会非常被动。
在国外,自2021年2月份以来,康希诺先后在墨西哥、巴基斯坦、匈牙利、智利等4个国家获得紧急使用授权。强生和阿斯利康疫苗的负面消息,会影响到它的海外合约吗?
放大灯向康希诺发去相关问题,截至发稿,未获回复。

舍近逐远,自造疫苗
从去年至今,康希诺在加紧自建疫苗生产车间的同时,也开始寻找合作代工方。与国内的代工方上海医药的生产线,到2021年7月份可以投产。而这距离康希诺获批上市,已间隔5个月。
另一家宣布进军腺病毒疫苗生产的企业,情况则更扑朔迷离。
旗下只有一款治疗心力衰竭的产品、从未进行过疫苗开发的西藏药业,去年11月宣布引进俄罗斯的卫星-V疫苗。
但半年时间过去了,西藏药业一支疫苗也拿不出。
到了4月初,心急的投资者在交易所互动平台上提问:“快马加鞭,争分夺秒,时间紧任务重,及时完整准确的披露,用词用的非常厉害。我就想知道你们的奉贤厂房几月份建好,卫星-V疫苗几月份能生产出第一瓶?”
对此,西藏药业回复称,其在上海奉贤园区的生产线建设已经开始,预计在2021年9月前完成生产线建设并投入生产[16]。从引进到试生产,西藏药业要花足足10个月。
如今看来,国内的腺病毒厂商,至少面对着两个问题:
一是,随着接种量的进一步提升,还不能排除疫苗出现血栓副作用的可能。仅仅是这种“可能”,对一款新冠疫苗撑起千亿市值的康希诺来说,已足够令资本市场和投资者焦虑。
而阿斯利康新冠疫苗在血栓问题上的后续表现,则会直接影响该疫苗的中国引进者——康泰生物的命运。
二是,国内腺病毒疫苗厂商的产能,出现了较为严重的“错配”问题。
在国内的腺病毒疫苗供应十分紧缺的情况下,整个行业却将要为国外代工1.6亿剂的疫苗。华兰生物是国内最大的流感疫苗公司,声名在外。源兴基因虽然名气不大,但它们都为俄罗斯代工卫星-V,足以证明这两家企业有制造腺病毒疫苗的能力(据相关报道,源兴基因的生产5月即会启动[17])。
既然如此,西藏药业、康希诺为何都死守自产疫苗的路线,而不是灵活地利用现有产能,及早让疫苗大规模上市?
康希诺尚且找了上海医药合作,但西藏药业明显并不心急。要再过5个月,它的产线才有可能建好。抑或是,“自建数亿产能”虽然极度艰难甚至并不现实。但藉此为投资者画出一张大饼,已绰绰有余。

References: