西北大学华人团队首次实现对内皮细胞的基因编辑,基因治疗心肺疾病和新冠重症成为可能
内皮细胞是覆盖在血管内表面的单层扁平上皮细胞,能够调控血管中的血流,在心血管稳态和组织液平衡中发挥重要作用。内皮细胞功能障碍是许多疾病的根源,比如高血压、动脉粥样硬化和糖尿病等,新冠病毒引起的呼吸窘迫综合征也与之相关。
CRISPR-Cas9是一种强大的基因编辑工具,然而迄今为止,仍缺少一种高效的系统能将外源物质递送至内皮细胞,即便目前科学家们已经开发出许多非病毒载体,但是依旧缺乏能够用于向除肝细胞和眼部细胞以外内皮进行高效递送的载体,这给内皮细胞的基因治疗带来挑战。
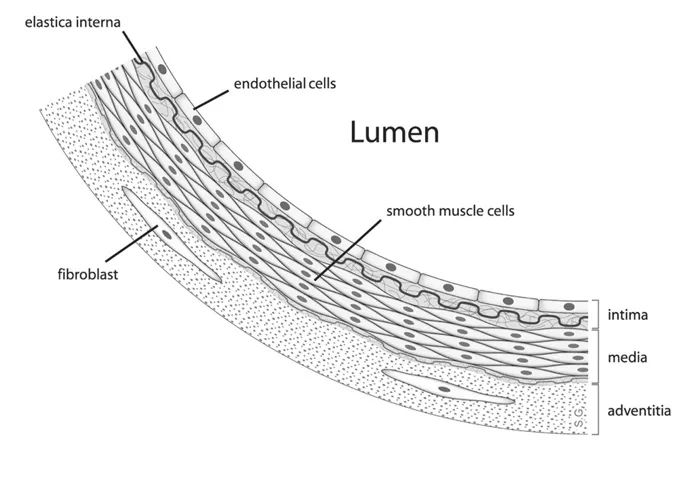
内皮细胞位置示意图 | Wikipedia Commons, Ondskapen / CC BY-SA 2.5(https://creativecommons.org/licenses/by-sa/2.5)
2022年1月4日,美国西北大学芬伯格医学院的赵友阳教授团队报道了一种新的方法,他们利用一种纳米颗粒,第一次成功将CRISPR-Cas9系统递送至血管内皮细胞并实现了高效的基因编辑。相关研究以封面故事形式发表在《细胞报告》(Cell Reports)杂志上。
论文通讯作者赵友阳教授告诉果壳:“我们开发的纳米颗粒是一种强大的新型血管内皮细胞基因编辑递送系统,可用于治疗多种疾病,包括许多血管内皮细胞功能失常造成的心肺疾病、肿瘤、抑制肿瘤转移,以及治疗严重 COVID-19 引起的急性呼吸窘迫综合征。”这种技术还可以同时编辑多个基因,对治疗由内皮功能障碍引发的疾病有重要意义。
内皮细胞高效基因编辑
赵友阳教授团队采用了不同分子量的PEG-b-PLGA(PP)共聚物进行测试,发现分子量为5K Da的PEG形成的PP纳米颗粒递送效率最高,再与分子量为25K Da的聚乙烯亚胺(PEI)进行孵育后,得到递送效率极高的PP/PEI纳米颗粒。研究团队发现这种用这种颗粒可实现对小鼠肝癌细胞高达90%的转导效率,并且用于体内递送时可实现较好的器官分布,在肝脏和肺部积累最多。
随后,研究团队利用该纳米颗粒包装携带特定gRNA的CRISPR-Cas9质粒,并通过静脉注射的方式注入成年小鼠体内。在基因编辑小鼠体内发现了因p110γPI3K表达破坏而导致的血管修复和炎症消退。最终,这种纳米颗粒在包括肺部、心脏、主动脉和外周血管在内的全身脉管系统上实现了内皮细胞的高效基因编辑。此外,携带质粒后,该颗粒对肝细胞的编辑效率仅有20%,且未对骨髓细胞产生编辑。
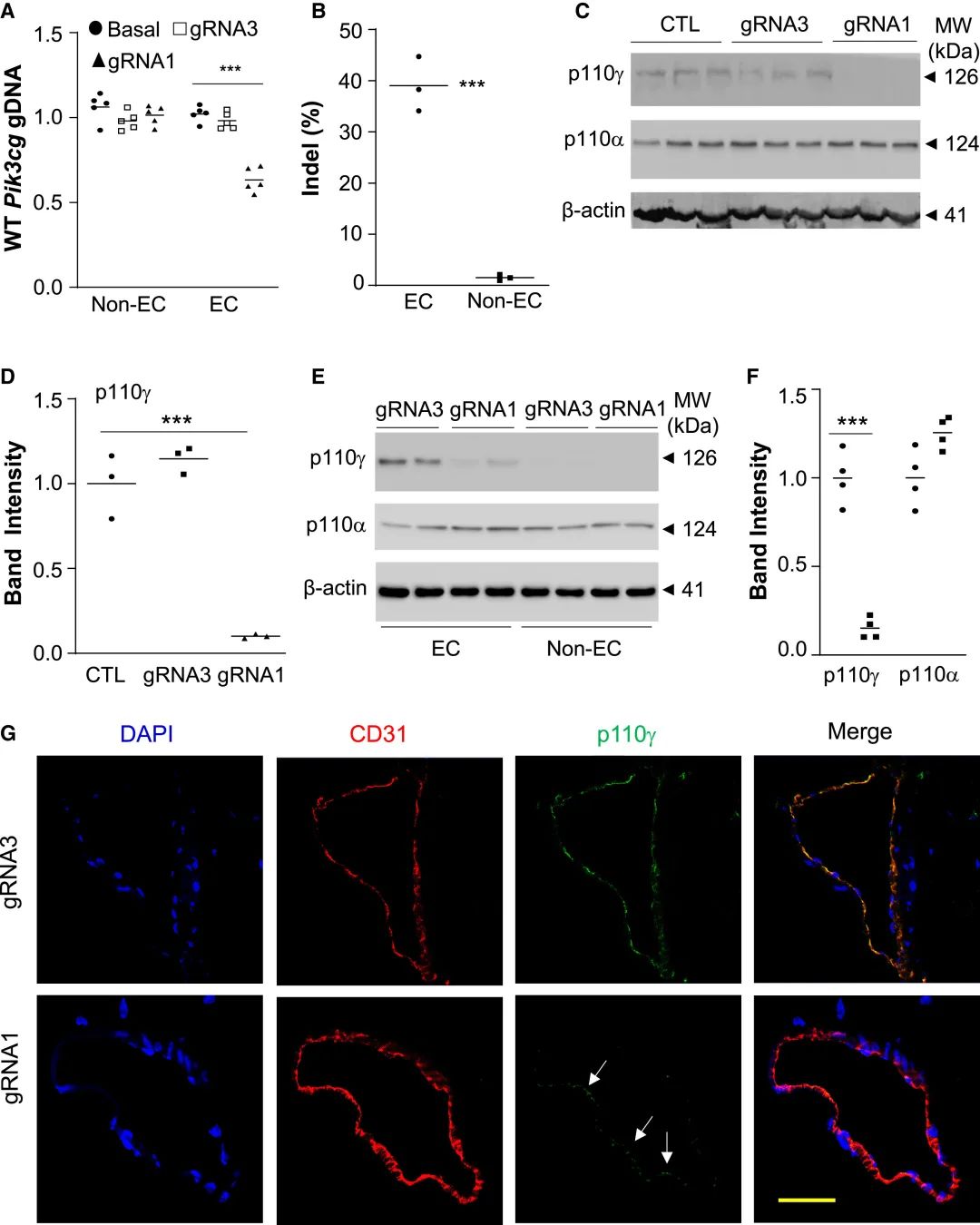
成功实现对成年小鼠心血管内皮细胞进行高效基因组编辑 | 参考文献[3]
系统优势
赵友阳教授团队开发的这种纳米颗粒载体,其制作所需的原材料容易获得,并且消除了病毒载体介导的Cas9扩展表达导致的DNA损伤的可能性。
“这种技术的优势是首次针对血管壁内皮细胞,整个心肺血管,在脑血管也有一定的效果;没有免疫原性;没有外源基因大小的限制,可同时改变多个基因的表达;对于基因编辑因为质粒DNA 是暂时,无长期脱靶担忧。” 赵友阳教授告诉果壳,“同时改变多个基因对绝大多数复杂的疾病的有效治疗很重要。”
该项研究打破了对内皮细胞进行基因治疗的瓶颈,使快速治愈因内皮细胞功能障碍而导致的疾病、快速血管内壁修复等治疗手段成为可能。
致谢
感谢美国西北大学赵友阳教授对本文的审阅和建议。
参考文献
作者:骁铭
编辑:酥鱼
排版:尹宁流
研究团队

通讯作者 赵友阳,本科毕业于复旦大学,博士毕业于中国科学院上海生物化学研究所,现任美国西北大学苏伯格医学院教授、苏伯格心血管研究所成员。
论文信息
发布杂志 《细胞报告》Cell Reports
发布时间 2022年1月4日
发布标题
Robust genome editing in adult vascular endothelium by nanoparticle delivery of CRISPR-Cas9 plasmid DNA
(DOI:10.1016/j.celrep.2021.110196)

点击阅读原文,即可查看原论文
