Nature:人工智能助力时间分辨冷冻电镜,北大毛有东团队发现重大药物靶点动力学调控机制
生命分子机器通过极其复杂的非平衡动力学过程和结构变化实现其特殊功能,这一过程也受到各种分子间相互作用的精准调控。如何直接观察原子水平天然态超大分子机器的功能态动力学过程,是对现有原子结构动态分析技术提出的空前挑战。精准观察生命分子机器的功能复合动力学对于靶向药物设计提供了传统技术难以获取的复合物动态标底,将推动新一轮原研药重大创新。
2022年4月27日,北京大学物理学院、介观物理国家重点实验室、国家生物医学成像科学中心、北大-清华生命科学联合中心、北大定量生物学中心毛有东教授团队在《自然》(Nature)杂志在线发表了题为“USP14-regulated allostery of the human proteasome by time-resolved cryo-EM”的研究论文,报道了一项突破性科学发现,利用自主研发的深度学习高精度四维重建技术,发展并应用时间分辨冷冻电镜,阐明原子水平人源蛋白酶体动力学调控和构象重编程机制。

网页截图
这是国际上首次将人工智能四维重建技术用于大幅提升时间分辨冷冻电镜分析精度,针对重大疾病靶标复合体,实现原子水平动力学观测的国际领先原创成果,展示了一类新型的蛋白质复合动力学研究范式。《自然》同期在线发表了题为“Control of human protein-degradation machinery revealed”的专栏推介文章,发表了审稿人和nature编辑团队的官方点评,其中审稿人评价:“该工作是一项重大研究,终于在原子水平解决了USP14活化和其调控蛋白酶体功能的机制问题。”nature编辑团队强调:“这一工作通过时间分辨冷冻电镜,结合功能分析,……,呈现了蛋白质降解过程中USP14和蛋白酶体的构象连续体。”
蛋白质降解调控是极其重要的基本生物化学过程,在细胞周期、信号转导、免疫响应、基因调控、新陈代谢、神经退行、癌症肿瘤、病毒感染以及蛋白毒性响应等主要细胞分子过程中发挥关键作用。在真核细胞中,绝大部分胞内蛋白都是通过泛素蛋白酶体途径(Ubiquitin-proteasome pathway)泛素化标记后,被蛋白酶体全酶降解的。2004年,Aaron Ciechanover, Irwin Rose和Avram Hershko三位科学家因发现该泛素化通路介导蛋白质降解过程而获得诺贝尔化学奖。
蛋白酶体全酶,又称为26S proteasome,是由中间一个圆柱形20S核心颗粒和两端覆盖的一个或两个19S调节颗粒组成。19S包含一个环形异源六聚体马达AAA-ATPase,通过多个协同ATP水解模式调控蛋白酶体降解泛素化底物。蛋白酶体是美国FDA批准的多种治疗癌症的上市小分子药物的直接靶标,其功能紊乱与人体多种疾病相关,如癌症、神经退行性疾病和免疫疾病等。
在正常细胞中,蛋白酶体的功能受到多个水平的严格调控,去泛素化酶USP14是最主要的蛋白酶体调控分子,有作为治疗癌症和神经退行性疾病重要靶标的潜力,其小分子抑制剂曾进入过一期临床研究。但围绕USP14功能机制的一系列悬而未决的关键问题极大限制了其靶向药物分子的开发和临床应用。USP14通过结合26S而被激活,然后以毫秒级的速度剪切底物上的泛素链。它被蛋白酶体激活并调控蛋白酶体功能的过程,一直是全球研究机构和生物制药界都十分关心的关键问题。
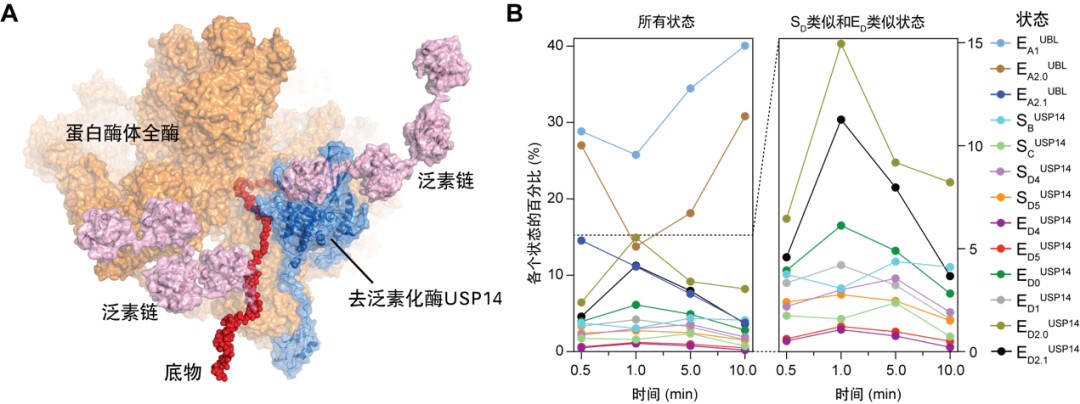
图1. (A) USP14调控下蛋白酶体复合体降解多泛素化底物的原子结构模型之一。(B) 时间分辨率冷冻电镜解析13种中间态的统计分布随蛋白质降解进程的时间演化 | Youdong Mao / CC BY 4.0(https://creativecommons.org/licenses/by/4.0/deed.zh)
毛有东教授课题组长期研究基于冷冻电镜的动力学重建方法及其生物医学应用课题,围绕蛋白酶体、炎症小体等具有重大临床应用前景的靶点系统的结构功能、动力学机制和靶向调控分子设计深入开展前沿交叉研究。此前开展的一系列工作揭示了蛋白酶体的原子架构、组装原理和降解泛素化底物的动力学基本规律。
本研究课题进行之初,首先要克服的问题就是“时间分辨”。蛋白酶体降解底物的过程很快,时间尺度在毫秒至秒之间。正常条件下,想要通过冷冻电镜技术捕获此过程的中间态结构非常困难,所以课题组首先要让这个过程慢下来。通过大量的条件摸索,重建反应动力学体系和优化反应条件,包括优化缓冲体系、反应温度等,课题组得到了较为可行的实验方案,使得时间分辨冷冻电镜技术应用成为可能,最终获得了含时的45,193张USP14-26S复合体降解泛素底物过程中的冷冻电镜透射图样,挑取了3,556,806个USP14-26S-泛素底物复合体的颗粒图像。
随后,冷冻电镜捕获的复合体图像需要归为不同的构象类别,才能呈现出蛋白反应的动态过程。USP14结合到26S蛋白酶体后,降解底物的动力学过程更加复杂,想要在如此多的异构复合体颗粒图像中,鉴别出降解过程各个时态的高分辨率非平衡构象,传统的三维分类方法是无法实现的。低精度的三维分类将导致低分辨的三维重建,无法获取原子水平的动力学信息,也无法对含时的数据赋予自洽的动态变化物理意义。
课题组结合经过数年自主开发的新型深度学习高精度三维分类和四维重建方法,捕获了USP14-26S复合体降解多泛素化底物过程的13种不同功能中间状态的高分辨率(3.0~3.6埃(Å))非平衡构象,通过时间分辨冷冻电镜分析,重建了受控蛋白酶体的完整动力学工作周期,并结合分子生物学功能和基因突变研究,阐明了USP14和26S相互调控活性的原子结构基础和非平衡动力学机制。
研究发现USP14的活化同时依赖泛素识别和蛋白酶体RPT1亚基的结合。出人意料的是,USP14通过别构效应,诱导蛋白酶体同时沿着两条并行状态转变路径发生构象变化。课题组成功捕获到了底物降解中间状态向底物抑制中间状态的瞬时转化。
在底物降解途径中,USP14活化变构地重编程AAA-ATP酶马达的构象景观(Conformational landscape)和统计分布,并刺激20S底物通道的打开,从而观察到底物持续转运过程的ATPase六聚马达非对称ATP水解和近乎完整的全周循环周期。USP14-ATPase的动态相互作用,使得ATPase马达底物识别与26S自身的去泛素化酶RPN11催化发生去耦合效应,并在26S的泛素识别、底物的起始易位和泛素链回收过程中引入三个调控检查点(动力学分岔点)。这些发现为USP14调节26S的完整功能周期提供了全新的高分辨见解,并为USP14靶向药物治疗发现奠定了极为重要的机制基础。
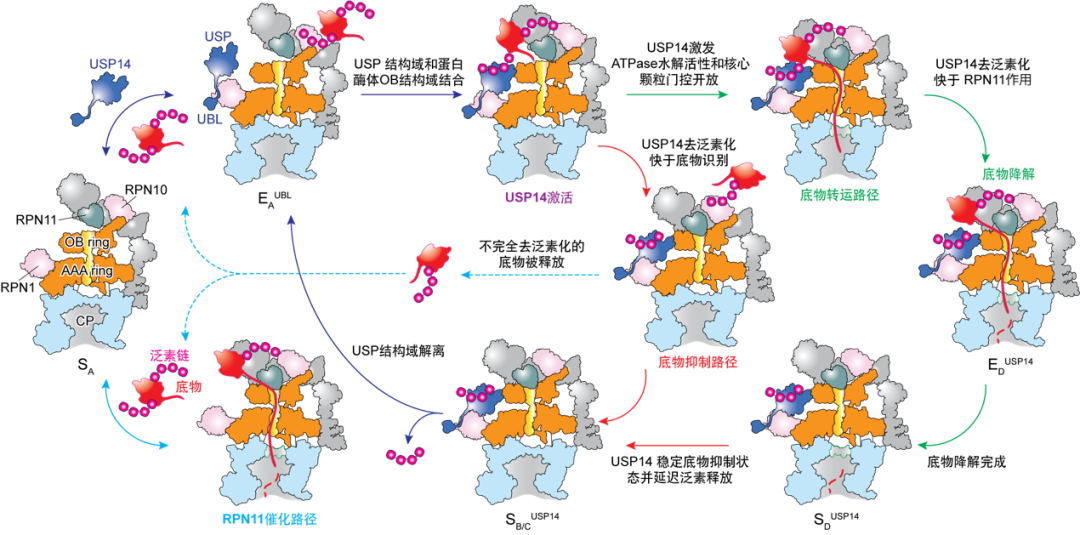
图2. 通过时间分辨冷冻电镜分析获取的USP14调控蛋白酶体底物降解的并行路径模型 | Youdong Mao / CC BY 4.0(https://creativecommons.org/licenses/by/4.0/deed.zh)
课题组博士后张书文与2019级博士生邹士涛为本论文的共同第一作者,毛有东教授为通讯作者。该论文的全部冷冻电镜数据在北大电子显微镜实验室和冷冻电镜平台上完成采集,大部分数据分析工作在北大高性能计算平台上完成。这项工作得到了北京市自然科学基金委员会重点专项、国家自然科学基金面上项目、国家杰出青年科学基金、国家重点实验室和北大-清华生命科学联合中心的支持。
致谢
参考文献
[1] https://doi.org/10.1038/s41586-022-04671-8
[2] https://doi.org/10.1038/d41586-022-01144-w
作者:邹士涛
编辑:靳小明 酥鱼
排版:尹宁流
题图来源:Pixabay
北京大学毛有东教授实验室介绍
毛有东博士现任北京大学终身正教授。毛教授实验室致力于数学物理科学、信息科学和生物医学的重大前沿交叉研究,主要通过发展新型交叉物理生物学方法,研究重要蛋白复合物动力学基本规律,及其对细胞关键生命分子过程调控机制和重大生物医学应用。实验室挂靠介观物理国家重点实验室、国家生物医学成像科学中心、北大-清华生命科学联合中心和北大定量生物学中心,曾获国家杰出青年科学基金、北京市基金委重点专项等经费支持。实验室当前主要研究方向包括:
(1)生命分子复合动力学规律和应用。细胞内重要的分子机器的组分和结构具有高度动态性,通常由复杂相互作用的众多分子构成,其功能执行体现为非平衡动力学过程。为了突破现有动态结构和动力学分析方法的局限性,本实验室聚焦时间分辨冷冻电镜、人工智能和统计物理的前沿交叉研究,发展动力学成像、重建和预测方法,发展基于深度流形学习的新型自由能面重建和预测方法,实现超大复合分子机器的动力学过渡态和最小能量反应路径的多维重建和预测,并以此为基础研究新型人工智能驱动蛋白质复合动力学辅助功能药物分子设计合成及医学应用。
(2)蛋白质降解动力学原理和应用。蛋白质降解调控是极其重要的基本生命分子过程,在细胞周期、免疫和炎症、基因表达、新陈代谢、神经退行、癌症肿瘤、病毒感染以及蛋白毒性响应等重要生理和病理过程中发挥关键调控作用。本实验室利用自主开发的冷冻电镜动力学成像和重建方法,研究由泛素和蛋白酶体体系(Ubiquitin-Proteasome System)介导的蛋白质降解动力学调控机制,尤其是其调控人类细胞中癌症、神经退行、炎症、病毒感染以及糖脂代谢等关键分子过程的结构动力学和功能关系;以此为基础,面向重大疾病和未满足的医学需求,研发新型靶向多特异性功能分子和蛋白降解新技术新方法。
(3)先天免疫反应动力学机制和应用。先天免疫系统通过炎症小体效应器来监控细胞环境的危险信号,它通过激活和高聚化形成炎症小体(Inflammasome),介导炎症反应并参与激活适应性免疫响应。炎症小体的失调可引起自发炎症或自体免疫相关疾病,如糖尿病、动脉粥样硬化等代谢疾病,阿尔茨海默症、多发性硬化等神经系统疾病。本实验室致力于研究炎症小体的激活反应的动力学原理和分子干预手段,试图理解先天免疫的信号转导过程、免疫调控以及病原诱导活化等免疫响应机理,为面向神经退行的分子医学提供新技术解决方案。
论文信息
发布期刊 《自然》Nature
发布时间 2022年4月27日
论文标题 USP14-regulated allostery of the human proteasome by time-resolved cryo-EM
(DOI:https://doi.org/10.1038/s41586-022-04671-8)
未来光锥加速器是果壳硬科技发起的早期科技创业加速器,为科学家创业提供从公司注册、知识产权,到融资需求、团队组建等不同阶段的方案建议。加速科技成果从实验室到市场的转化,加速一部分科学家迭代成为CEO。
果壳团队有着长达12年为科学家服务的经验,我们始终站在科学家的视角出谋划策,做科创者的好朋友。如果您正打算创办一家科技企业,无论是找钱、找人、找资源,还是找订单,都欢迎与未来光锥团队聊聊。您可发送bp或其他项目资料到wlgz@guokr.com,并留下联系方式,或添加果壳硬科技企业微信,私信沟通。

✦
✦
点击阅读原文即可查看原论文
